內毒素存在于革蘭氏陰性菌的外膜上,通過引發一系列免疫反應對人體健康構成威脅。因此,對其進行準確檢測至關重要。
內毒素
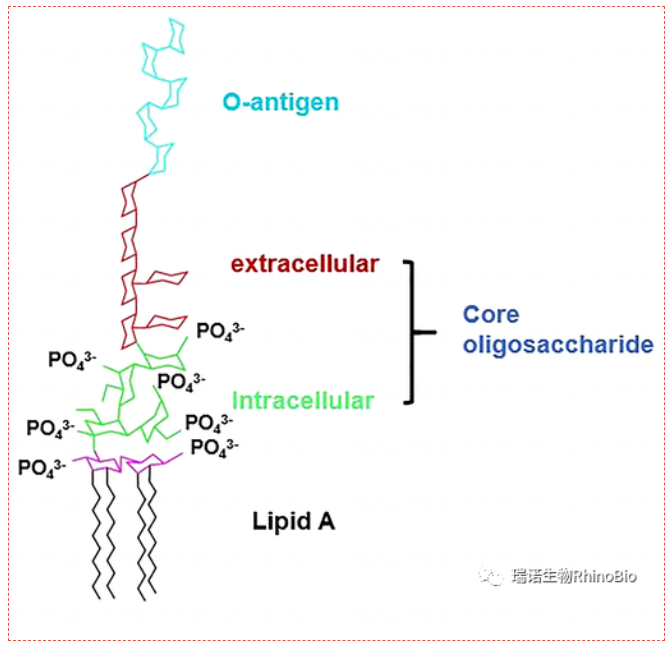
內毒素(化學上稱為脂多糖或 LPS)是一種固定在革蘭氏陰性菌外膜上的成分。它可以分為三部分:暴露于外部環境的雜多糖O-抗原、具有胞內和胞外結構域的核心寡糖以及細胞膜下方的脂質A。根據其化學結構,LPS 屬于兩親屬性。
內毒素分子被脂質 A 錨定在細胞壁內,但會不斷釋放到周圍的培養基中,不僅在細胞死亡時,而且在其生長和分裂過程中也是如此。一旦內毒素進入血液循環,免疫細胞對其進行識別,就會導致細胞內信號通路的快速激活,從而釋放血管活性肽和細胞因子等促炎介質。上述過程可能導致發熱、休克,甚至死亡。由于其在滅菌過程中對人體健康存在潛在危害且具有較高的化學穩定性,因此生物制品類、注射用藥劑、抗生素類、疫苗等制劑以及醫療器材類必須經過細菌內毒素檢驗合格后才能使用。
內毒素檢測的方法
多年來,用于檢測和量化內毒素的測試方法不斷發展,以提高其靈敏度。鱟變形細胞裂解物 (LAL) 測定是內毒素檢測的藥典測試。該測定的試劑是來自鱟 (Limulus) 變形細胞裂解物的凍干產物。除了 LAL 檢測外,Tachypleus(另一種鱟)變形細胞裂解物 (TAL) 檢測也被批準用于內毒素檢測。
此外,隨著重組C因子內毒素檢測方案供應商越來越多,法規也越來越明朗,因此被廣泛接受。其檢測原理更為明確,原料可控,因此被用于更為準確的內毒素含量檢測,成為傳統鱟試劑檢測的補充或替代方法。
無論哪種內毒素檢測方法,整個檢測體系正常工作的最重要的條件在于內毒素分子本身、酶、檢測樣品屬性以及其他條件和諧共處,這些因素如果出現狀況都會導致內毒素檢測產生抑制或增強作用,統稱干擾,導致結果不準確。
但是......不要怕,實驗前,做到知己知彼,方能百戰百勝!
我們來看看到底都有哪些會是內毒素檢測的干擾因素。
首先,做實驗的時候不淡定是最大的干擾因素,開個玩笑......
言歸正傳,真正的干擾一般來源于如下幾個方面:
1、內毒素的自身屬性
? 內毒素分子本身是兩親性的分子。兩親性導致內毒素會在水相中聚集分布,內部疏水,外部親水。文獻表明聚集體太大不利于內毒素活性顯現,單體分布也不利于活性呈現。聚集-分散是一個動態過程,受到二價金屬離子(Ca2+,Mg2+)和pH(H+)、非離子型去垢劑影響;
? 負電荷基團(PO43-,糖基)在一定條件下也會和正電荷位點或者陽離子相互結合。
2、樣品環境,如溫度,pH, 去垢劑,二價金屬離子,滲透壓等
? 低pH下,質子會和二價陽離子競爭,打破聚集體動態平衡;
? 二價金屬離子(Ca2+,Mg2+)促進鹽橋形成而促進LPS聚集,因此內毒素檢測會受到金屬離子螯合劑干擾,EDTA有六個金屬離子配位點,因此干擾最強,其次是檸檬酸;
? 由于去垢劑也有兩親性,可能會取代內毒素并形成占位效應,導致聚集體組成變化形成干擾,其中PS-20擴散比PS-80快,因此PS-20干擾更大;
? 低溫下(2-8℃或-20℃)聚集體形成較慢,同時非離子型去垢劑占位形成內毒素-去垢劑復合體的速度也比較慢,因此干擾會比較低;
? 過高濃度的鹽或糖溶液(如50%的葡萄糖或5%的氯化鈉溶液)通常會抑制試劑反應。因為高滲透壓的溶液會從試劑吸水,從而使酶失活,造成抑制;
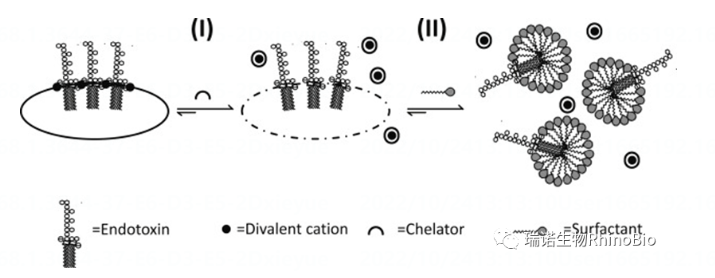
LPS聚集狀態動態圖(Johannes Reich et al., 2016)
3、樣品屬性,如電荷,親水或疏水特性
? 正電荷蛋白結合內毒素負電荷位點。在陽離子蛋白溶菌酶、核糖核酸酶A 和人IgG樣品內毒素檢測中,發現了蛋白質對內毒素的掩蓋,即使對樣品進行稀釋也無法解決。
? 蛋白和內毒素疏水相互作用,包裹內毒素導致活性無法檢測
4、其他干擾成份(蛋白酶,抑制劑,復雜成份、佐劑)
? pH值在6~8范圍酶活性最佳,因此樣品pH值盡量不能低于5不能高于9;
? 高濃度變性劑會使得蛋白(酶)變性,喪失活性;
? 如反應體系中有蛋白酶,也會因為降解活性物質,如C因子,導致檢測受到干擾,結果不準確;
? 絲氨酸蛋白酶抑制劑會抑制C因子底物酶切活性,干擾檢測;
? 血清中復雜成份干擾等;
? 疫苗領域常會遇到的氫氧化鋁佐劑吸附內毒素導致檢測干擾問題。
以上只是把可能的干擾條件列舉出來,我們真正在樣品內毒素檢測中,能夠同時遇到2個以上問題就算中獎了。所以,我們要做的事情是,在遇到干擾的時候,理性分析樣品屬性,看看可能會是什么原因,然后對癥下藥,便可解決。
下一期,我們再看看以上問題可以如何解決,敬請期待…….
[1] Rui xuan Bu, Xinren Deng, Yuan Cao.Effect of different sample treatment methods on Low Endotoxin Recovery Phenomenon, Journal of Microbiological Methods,Volume 186, July 2021, 106241.
[2] Yuan Cao. Low endotoxin recovery and its impact on endotoxin detection, Biopolymers, Volume112, Issue11 November 2021
[3] Johannes Reich, Pierre Lang. Masking of endotoxin in surfactant samples: Effects on Limulus-based detection systems, Biologicals Volume 44, Issue 5, September 2016, Pages 417-422
[4] PDA Technical Report No. 82 (TR 82) Low Endotoxin Recovery, PDA, 2019.